Как различить этиленгликоль и этанол
Как различить этиленгликоль и этанол


- Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.
- Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей.
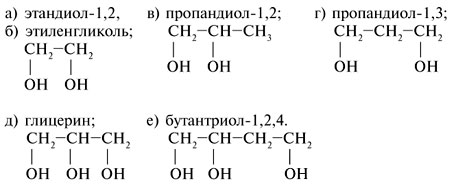
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:

Получение многоатомных спиртов
I . Получение двухатомных спиртов
1. Каталитическая гидратация оксида этилена (получение этиленгликоля):

2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:

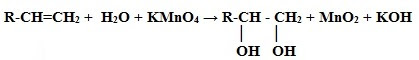
II . Получение трёхатомных спиртов (глицерина)
Омыление жиров (триглицеридов):

Химические свойства многоатомных спиртов
1. С активными металлами:
2. С гидроксидом меди( II ) – качественная реакция!


1. С галогенводородными кислотами

Т ринитроглицерин – основа динамита
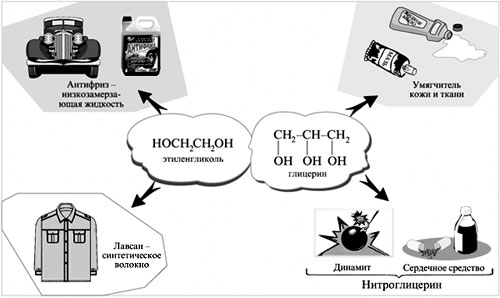
- Этиленгликольпроизводства лавсана, пластмасс, и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время); сырьё в органическом синтезе.
- Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканейи в других областях народного хозяйства. Сорбит(шестиатомный спирт) используется как заменитель сахара для больных диабетом. Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
Источник: www.sites.google.com
Спирты
Химические свойства спиртов
1. Спирт, как и многие органические вещества, горит с образованием углекислого газа и воды:
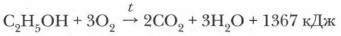
Этиловый спирт горит бледно-голубым пламенем, выделяя большое количество теплоты.
2. Химические свойства спиртов определяются свойствами функциональной группы —ОН:
а) если нагреть этиловый спирт со смесью концентрированной серной кислоты и бромида калия или натрия, то через некоторое время мы увидим образование бромэтана — тяжелой жидкости с запахом горького миндаля:

б) при сильном нагревании спирта с концентрированной серной кислотой происходит отщепление молекулы воды от одной молекулы спирта и образуется непредельный углеводород (вспомните, как вы получали этилен в лаборатории):
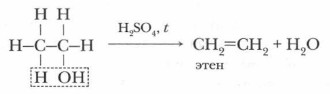
Многоатомные спирты — это спирты, содержащие в молекуле несколько гидроксильных групп. Их простейшими представителями являются этиленгликоль и глицерин:

Этиленгликоль — бесцветная сиропообразная жидкость, сладкая на вкус, хорошо растворимая в воде. Ядовит. Водные растворы этиленгликоля используют в качестве антифризов — жидкостей, замерзающих при низкой температуре. Например, раствор, содержащий 60 % этиленгликоля, замерзает при -49 °С. Антифриз добавляют для охлаждения двигателей внутреннего сгорания в зимний период.
Глицерин — вязкая, бесцветная, сладкая на вкус жидкость. Хорошо растворим в воде, нетоксичен. Широко используется в косметической, медицинской и фармацевтической промышленности (кремы, шампуни, мази), в кожевенном производстве (для предохранения кож от высыхания), в текстильной промышленности (для придания тканям мягкости и эластичности).
Многоатомные спирты вступают во все реакции, характерные для одноатомных спиртов. Присутствие нескольких гидроксильных групп в составе многоатомных спиртов придает им слабые кислотные свойства. В отличие от одноатомных спиртов они взаимодействуют с гидроксидами металлов. При взаимодействии многоатомного спирта с гидроксидом меди (II) в щелочной среде образуется темно-синий раствор (гликолят меди и глицерат меди). Эта реакция является качественной реакцией на многоатомные спирты.
 Лабораторный опыт. Качественная реакция на многоатомные спирты. К 2 мл раствора щелочи добавьте несколько капель раствора сульфата меди (II). К образовавшемуся осадку прилейте глицерин и смесь взболтайте. Что наблюдаете? Отметьте признаки химической реакции.
Лабораторный опыт. Качественная реакция на многоатомные спирты. К 2 мл раствора щелочи добавьте несколько капель раствора сульфата меди (II). К образовавшемуся осадку прилейте глицерин и смесь взболтайте. Что наблюдаете? Отметьте признаки химической реакции.
Функциональная группа спиртов • Метанол • Этанол • Многоатомные спирты (этиленгликоль, глицерин) • Качественная реакция на многоатомные спирты
Вопросы и задания
 1. Чем опасен для организма человека этиловый спирт?
1. Чем опасен для организма человека этиловый спирт?
 2. В отличие от растворов щелочей предельные одноатомные спирты, в состав которых входит гидроксильная группа, не изменяют окраски индикаторов. Какой можно сделать вывод?
2. В отличие от растворов щелочей предельные одноатомные спирты, в состав которых входит гидроксильная группа, не изменяют окраски индикаторов. Какой можно сделать вывод?
 3. С какими из перечисленных веществ будет взаимодействовать метанол: водород, вода, бром, бромоводород, кислород, серная кислота? Напишите уравнения реакций.
3. С какими из перечисленных веществ будет взаимодействовать метанол: водород, вода, бром, бромоводород, кислород, серная кислота? Напишите уравнения реакций.
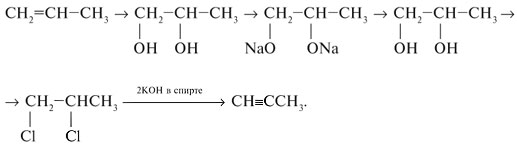
 4. Напишите уравнения химических реакций, соответствующих схеме, и укажите условия их протекания:
4. Напишите уравнения химических реакций, соответствующих схеме, и укажите условия их протекания:
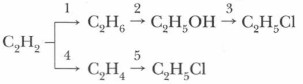
 5. Напишите формулы двух гомологов глицерина.
5. Напишите формулы двух гомологов глицерина.
 6. Как химическим способом отличить этиленгликоль от метанола или этанола?
6. Как химическим способом отличить этиленгликоль от метанола или этанола?
Источник: xn--24-6kct3an.xn--p1ai
Урок 20. Многоатомные спирты
Многоатомные спирты – это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных с углеводородным радикалом.
Группы ОН в многоатомных спиртах размещаются у разных атомов углерода:
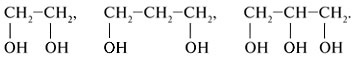
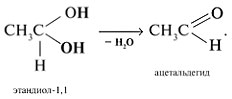
Соединения с двумя группами ОН при одном атоме углерода неустойчивые. Они отщепляют воду и превращаются в альдегиды:
Соединения с двумя группами ОН при соседних атомах углерода называют гликолями (или диолами).
Получение
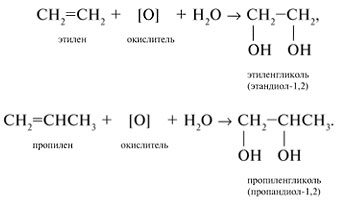
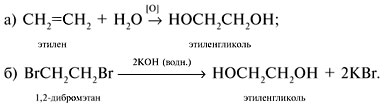
 Гликоли получают окислением алкенов в водной среде. Например, при действии перманганата калия или кислорода воздуха в присутствии серебряного катализатора алкены превращаются в двухатомные спирты:
Гликоли получают окислением алкенов в водной среде. Например, при действии перманганата калия или кислорода воздуха в присутствии серебряного катализатора алкены превращаются в двухатомные спирты:
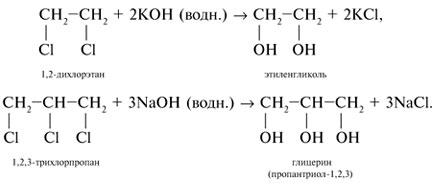
 Другой способ получения многоатомных спиртов – гидролиз галогенпроизводных углеводородов:
Другой способ получения многоатомных спиртов – гидролиз галогенпроизводных углеводородов:
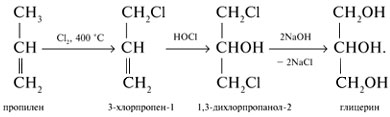
 На производстве глицерин получают по схеме:
На производстве глицерин получают по схеме:
Физические свойства
Этиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч. 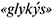 – сладкий). Растворимость в воде – неограниченная. Температуры кипения этиленгликоля – 197,2 °С, глицерина – 290 °С. Этиленгликоль – яд.
– сладкий). Растворимость в воде – неограниченная. Температуры кипения этиленгликоля – 197,2 °С, глицерина – 290 °С. Этиленгликоль – яд.
Химические свойства
Этиленгликоль и глицерин подобны одноатомным спиртам.
 Так, они реагируют с активными металлами:
Так, они реагируют с активными металлами:
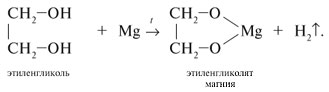
 Многоатомные спирты в реакции с галогеноводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена:
Многоатомные спирты в реакции с галогеноводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена:
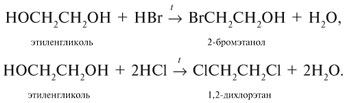
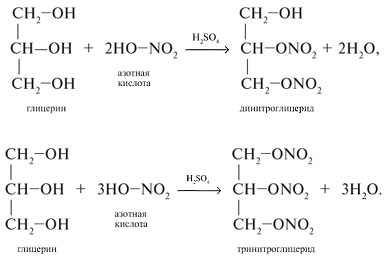
 Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды:
Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды:
 Качественная реакция многоатомных спиртов, позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В щелочной среде при достаточной концентрации глицерина голубой осадок Cu(OH)2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II):
Качественная реакция многоатомных спиртов, позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В щелочной среде при достаточной концентрации глицерина голубой осадок Cu(OH)2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II):
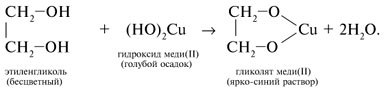
 |

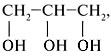
 моногалогенуглеводород
моногалогенуглеводород 
 С(О)O–]n;
С(О)O–]n; 

 КОНЬЯК ИЗ САМОГОНА. ВСЯ СУТЬ НАПИТКА +3 РЕЦЕПТА В ДОМАШНИХ УСЛОВИЯХ
КОНЬЯК ИЗ САМОГОНА. ВСЯ СУТЬ НАПИТКА +3 РЕЦЕПТА В ДОМАШНИХ УСЛОВИЯХ
